皮膚に表現される疾患の全てを対象とする皮膚科学では、その研究対象が非常に多岐にわたる。当教室では、免疫学的手法を用いて種々の皮膚疾患の病態解明にアプローチし、解答を導き出すことを目標とし、さらに、研究が臨床にフィードバックできるよう心掛けている。当教室のこれまでの業績を基盤として免疫・アレルギー、自己免疫疾患などが主な研究分野となりつつあり、研究成果は世界に向けて発信されている。
皮膚自己免疫性疾患で見られる苔癬反応(interface dermatitis)とそれに引き続く皮膚線維化の機構の解明
皮膚の自己免疫疾患や重症薬疹では、表皮角化細胞死を特徴とする苔癬反応(interface dermatitis)が見られますが、その機構の解明は十分でなく、したがって特異的治療法も存在しません。我々は、人工的な皮膚自己免疫性皮膚炎モデルである移植片対宿主病様皮膚粘膜疾患モデルマウスや同種異系骨髄移植誘導で惹起する移植片対宿主尿モデルマウスを用い、この機構の解明に取り組んでいます。特に細胞傷害性CD8 T細胞はこの病態の中心的な役割を担っており、産生するパーフォリンーグランザイムB経路が角化細胞死を引き起こしていることを示し、企業との産学共同研究にて、この経路を標的とした、まったく新しい治療薬の開発に取り組んでいます。また、表皮に常在する樹状細胞であるランゲルハンス細胞は、皮膚炎におけるその役割については多くの相反する説が提唱されておりますが、我々は、少なくとも自己免疫反応においては免疫抑制的に働いていることを突き止め、その機構について、さらなる解明に進んでいます。移植片対宿主病や、膠原病の強皮症をはじめ、皮膚自己免疫疾患では、炎症後に皮膚線維化による硬化を来すのも特徴です。この機構についても、角化細胞死をキーワードに病態の解明を進めています。
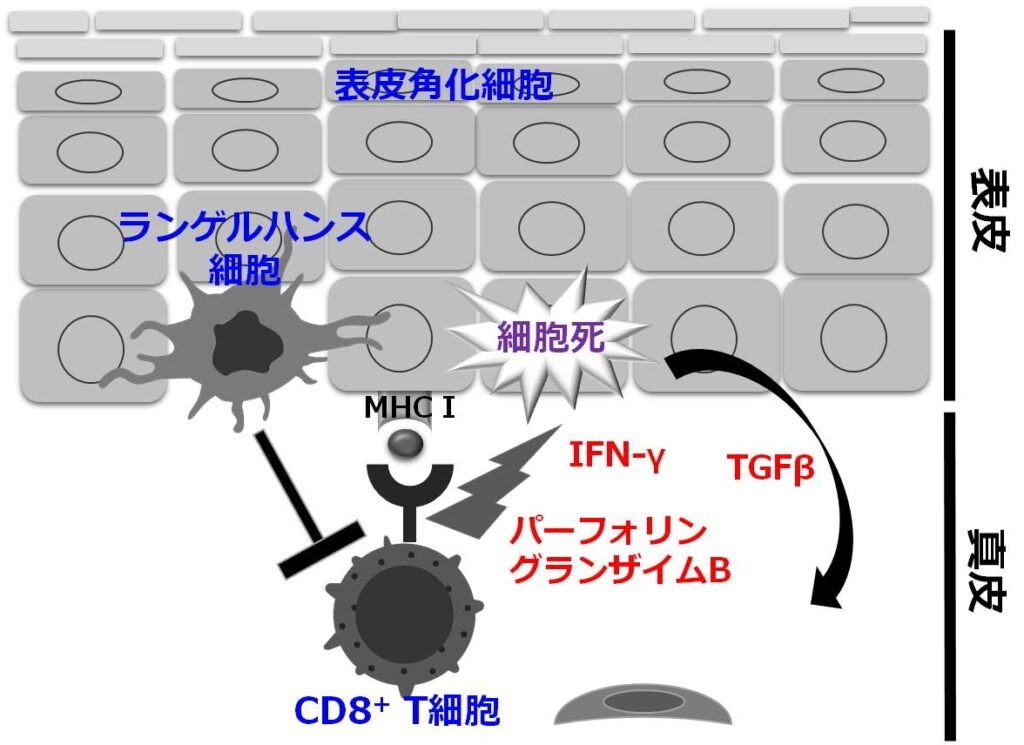
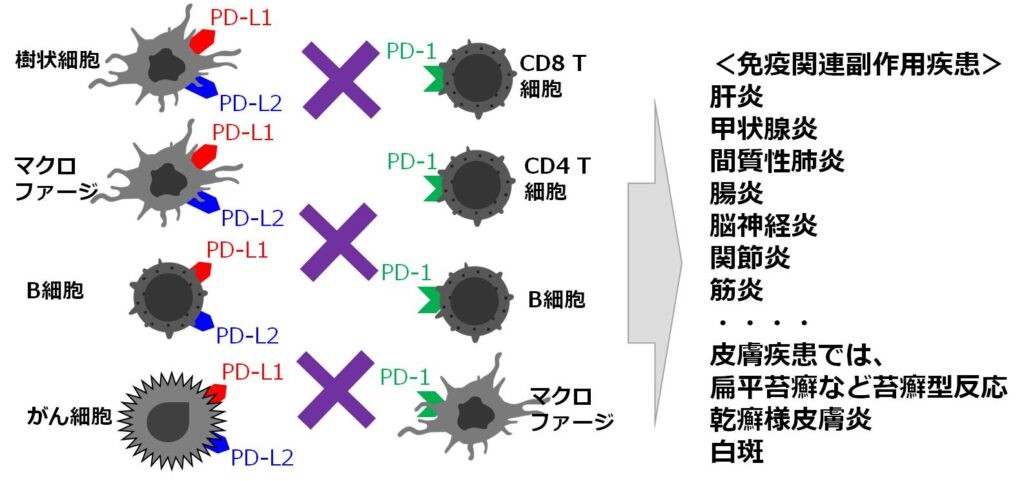
免疫チェックポイント阻害薬誘導免疫関連副作用の病態解明と特異的治療法開発
近年、皮膚科分野の癌である悪性黒色腫対象を皮切りに、抗programmed cell death-1(PD-1)抗体、抗programmed cell death lignad 1(PD-L1)抗体といった免疫チェックポイント阻害薬による癌免疫療法が盛んに行われています。PD-1や、そのライガンドであるPD-L1、PD-L2は、末梢トレランス機構を司っており、その阻害は癌免疫を強化するとともに、自己免疫疾患を惹起し、免疫関連副作用(immune-related adverse effects: irAEs) が臨床的な問題となってきています。我々は、irAE症例検体を用いた臨床研究と共に、独自のコンディショナルノックアウトマウス系を構築し、様々な炎症性疾患モデルマウスや癌モデルマウスを用いて、PD-1-PD-Ls機構がどの部分で癌免疫を強化し、その部分でirAEを引き起こしてくるのかを解明し、より効率的な癌免疫療法の開発とともに、いまだ対処法が確立されていないirAEの治療法の開発に結び付く研究に取り組んでいます。
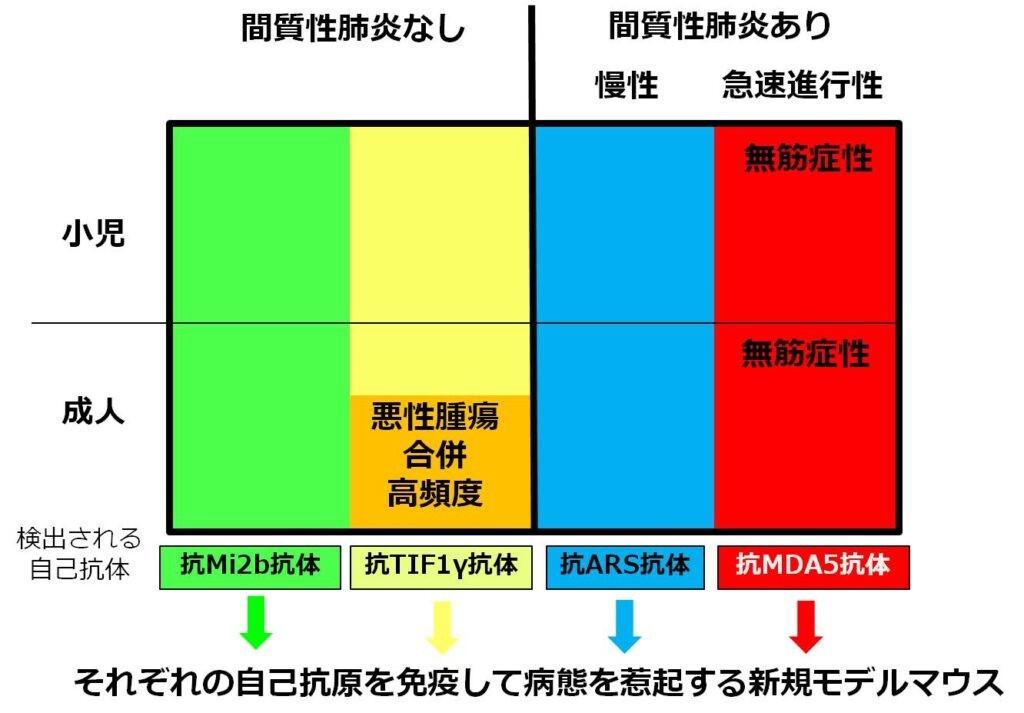
皮膚筋炎の病態に則した新規モデルマウスの開発と分析
代表的な膠原病の一つである皮膚筋炎は、筋炎、間質性肺炎、皮膚炎を呈し、その皮膚症状を含めた臨床像や予後は、筋炎特異的自己抗体別に分類できることが分かってきました。一方、モデルマウスは、自己免疫性筋炎を起こす、Experimental Autoimmune myositisやC-protein induced myositisのような筋炎特異抗原の免疫によって惹起するものがあり、これらの解析も行ってきましたが、実際の皮膚筋炎の病態とは合致していない懸念がありました。我々は、筋炎特異的自己抗体別サブグループ分類に応じた、筋炎や間質性肺炎の新規モデルマウス群を作製しており、この解析を通じて、サブグループ別病態解明と特異的治療法開発に結び付けることに取り組んでいます。
皮膚筋炎の新規自己抗体探索
上述のように、皮膚筋炎の筋炎特異的自己抗体には、保険収載されたELISA検査が存在する抗Mi2b抗体、抗TIF1γ抗体、抗ARS抗体(抗Jo-1抗体を含む)、抗MDA5抗体以外に、抗SAE抗体、抗NXP2抗体、抗TIF1β抗体などがあり、現状では、我々の研究室で免疫沈降法ーウェスタンブロット法での検出法を確立して同定し、これらの抗体別の臨床研究を行っています。 さらに、これらの既知の筋炎特異的自己抗体のどれも検出されない皮膚筋炎症例もまだ存在するため、我々は、皮膚筋炎であることが確実な症例で既存の筋炎特異的自己抗体がすべて陰性である血清を多施設より集積し、破砕細胞免疫沈降法を用いた新規自己抗体の探索を行っています。
- 患者さまへ:『皮膚筋炎・多発性筋炎の自己抗体同定』について
文書のダウンロード - 本研究に関する問い合わせ先: ikykderm@tmd.ac.jp
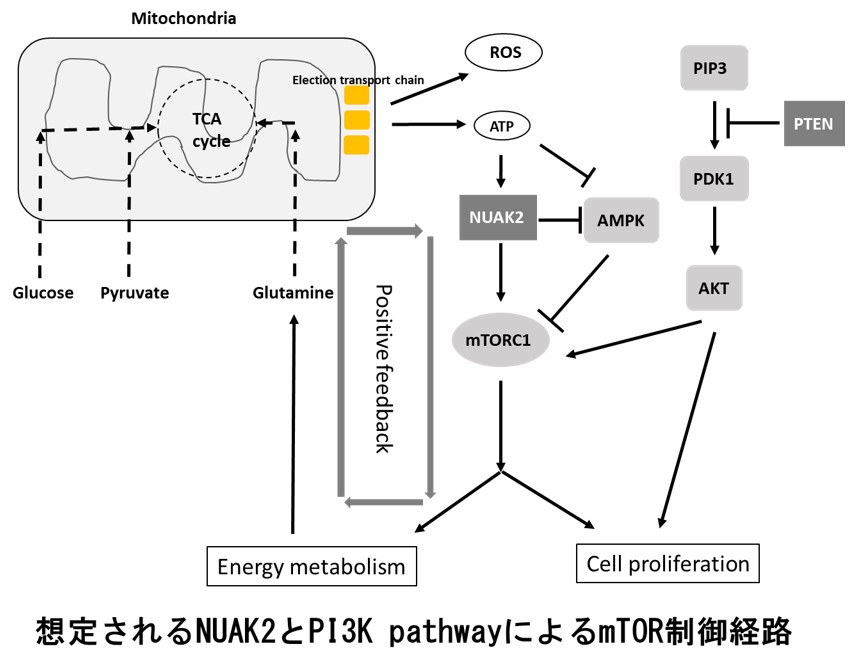
末端黒子型悪性黒色腫発症機構の解明と新規分子標的治療法の開発
わが国に頻度の高い末端黒子型悪性黒色腫は欧米人に多い表在拡大型悪性黒色腫と比較して予後が悪く、免疫チェックポイント阻害剤の効果も低いことが分かってきています。末端黒子型と表在拡大型は全く異なったゲノム異常を有していることが近年の次世代シークエンサーを用いた解析からも明らかになっており、末端黒子型の発症機序と直結した遺伝子異常を標的とした新規の分子標的治療薬の開発が急務となっています。我々は世界に先駆けて末端黒子型悪性黒色腫の予後と強く相関する遺伝子異常としてNUAK2増幅を特定し、細胞レベルの解析やマウスモデルを用いた解析および臨床検体を用いた検証などを含めて多角的な観点から末端黒子型悪性黒色腫の発症機構の解明に取り組んでいます。さらにNUAK2の機能を抑制することで悪性黒色細胞の増殖を著明に抑制できることから、NUAK2をターゲットとしたキナーゼ阻害剤やCRISPR interference法および核酸医薬などを用いた新規治療法の開発にも取り組んでいます。
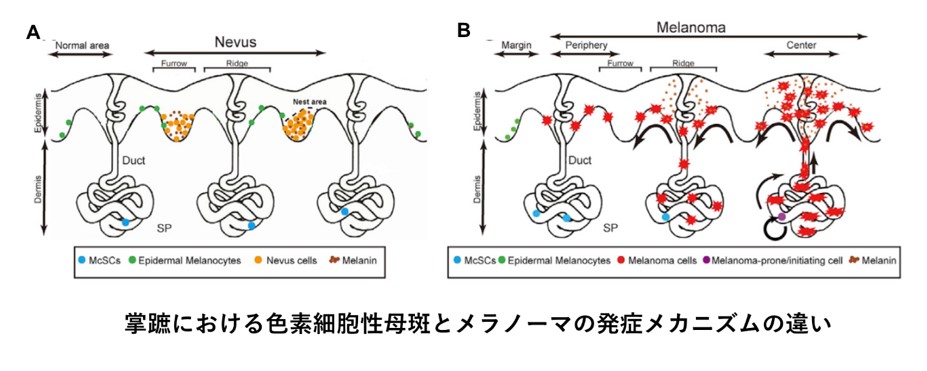
末端黒子型悪性黒色腫起始細胞の特定と新規診断法の開発
癌発症の最初期の細胞(起始細胞)を特定することは癌発症機構の解明に重要なことと考えられますが、必ずしも各癌腫にて起始細胞が特定されている訳ではありません。特に皮膚は最も観察が容易な臓器でもあることから、皮膚腫瘍を用いて解析を進めることで癌発症機構の詳細につき解明が進むものと思われます。共同研究者の西村らはマウスモデルを用いることで末端黒子型悪性黒色腫の起始細胞が掌蹠の汗腺腺体部に存在する色素幹細胞であることを突き止め、その発症形式の詳細につき詳しく解析を進めることで末端黒子型悪性黒色腫の誘発因子につき実験的に明らかにすることに成功しました。当科においても東京大学医科学研究所と共同にて、マウスモデルにおける知見がヒトにおいても敷衍されるか確かめるためさらなる詳細な臨床病理学的な解析を進めています。そして、この知見が発症機構の解明のみならず末端黒子型悪性黒色腫の非常に早期の病変の特定に極めて有用であることを示し、掌蹠における“ホクロ”と“メラノーマ”の鑑別がより早期にて可能となるよう新規早期診断法の開発に取り組んでいます。
好塩基球の活性化と制御機構の解析
好塩基球は末梢血白血球の0.5%に満たない希少な細胞である。高親和性IgE受容体を有し、ヒスタミンなどの化学伝達物質を遊出することから、古くは血中のマスト細胞と見なされてきた。近年行われたマウスモデルを用いた解析により、皮膚炎症の形成において、好塩基球が独自の非常に重要な役割を担うことが明らかになった。私たちの研究室では、好塩基球が関連する皮膚炎症の病態を解明するために、好塩基球が産生するメディエーターとその制御機構に関する研究を行っている。好塩基球におけるプロテアーゼ産生は不明であったが、マウス好塩基球においては、グランザイムBに類似したmouse mast cell protease (mMCP) 8と、トリプターゼのmMCP11という2種類のプロテアーゼが特異的に発現することを、本学高等研究院の烏山一教授との共同研究で明らかにしている。皮膚炎症に浸潤する好塩基球においてこれらのプロテアーゼが発現することを示している。好塩基球におけるアラキドン代謝は詳細は不明であったが、好塩基球がIgG刺激ではなくIgE刺激によりプロスタグランディンを産生することを明らかにしている。好塩基球はTh2細胞よりも多量なIL-4を産生することが報告されてきているが、その制御機構に亜鉛シグナルが関与することを理化学研究所の平野俊夫教授との共同研究により解明し、アレルギー診断にも用いられる代表的な好塩基球活性化マーカーであるCD203cと亜鉛関連分子の発現に相関があることを明らかにしている。
痒疹の病態解析と病態に則した新規治療の開発
慢性痒疹は結節性痒疹と多形慢性痒疹に分類されるが、その免疫学的な差異は明らかになっていない。当研究室では慢性痒疹患者168名の血液データ・病理組織を後ろ向き解析し、共に2型炎症反応がみられるものの、多形慢性痒疹はその傾向が顕著であることを明らかにした。また病理組織においては、好酸球のほか好塩基球浸潤が認められ、共に浸潤密度に差異はないものの、特に好酸球の局在には差異があることを明らかにしている。染毛剤に含まれるp-phenylenediamineは遅延型アレルギー反応として時に痒疹反応を引き起こすが、病理学的な特徴は、慢性痒疹とは異なり、表皮において好塩基球と好中球・IL-17陽性細胞の浸潤が見られることを明らかにした。2型炎症反応が病態の中心を担うアトピー性皮膚炎で近年承認され、良好な治療成績をおさめるIL-4/IL-13受容体抗体製剤は、国内外で結節性痒疹における臨床試験が実施され良好な治療効果を認めている。当教室では多形慢性痒疹における同製剤の有効性を臨床研究で検討している。さらに、当研究室では痒疹においては、蕁麻疹と同様に、好塩基球が活性化状態にあることを明らかにしており(Ito Y. Allergy, 2011)、Th2サイトカインのほか、好塩基球が炎症の形成に関わっていると仮説を立て、好塩基球を標的とした治療としてIgE抗体製剤の有効性について臨床研究で検討し、多形慢性痒疹の一部において有効であることを明らかにしている。
成人型食物アレルギーの病態解析と経口免疫療法の有効性
近年、皮膚は食物アレルギーの感作経路として注目されている。成人型食物アレルギーにおいても、職業性などによる経皮感作は代表的な発症機序の一つである。感作経路を断つことで、長期的に治癒に至る症例もあるが、難治な症例も経験する。当研究室では経皮感作型の食物アナフィラキシーモデルマウスを樹立し病態解析を行っている(Yu R. et al. Exp Dermatol, 2017)。最近は、このモデルマウスを用いて、経口免疫療法の有効性と病態解析を行った。経皮感作前の経口負荷も一定の寛容を誘導するが、感作期の経口負荷はより顕著に寛容を誘導することを明らかにしている。さらに実際の経皮感作型食物アレルギーの成人患者において、低アレルゲン化した食物抗原を用いた経口免疫療法を施行し、感作状態や好塩基球活性化の軽減、摂取許容量の増量が見られることを、臨床研究にて明らかにしている。
アトピー性皮膚炎における核酸医薬による外用療法の検討
横関博雄名誉教授が中心となり、核酸医薬によるアトピー性皮膚炎の外用治療に関する検討を行ってきた。STAT6 decoy ODN(おとり核酸)を用いた手法である。本来、活性化された転写因子が、DNA上の結合部位(binding site)に結合することによって遺伝子の発現がなされる。ここに、人工的に合成したDNA結合部位をおとり核酸として細胞内に大量に導入すると、活性化された転写因子は、大量にあるおとり核酸の方により多く結合することとなり、結果として、遺伝子発現は競合的に抑制されることになる。井川健元准教授(現 獨協医科大学教授)が中心になり、STAT6 decoy ODN軟膏を用いた医師主導型の臨床研究がなされ、外用により皮膚症状と痒みが改善することを明らかにしている。一方、こうした核酸医薬における問題として、核酸の分子量が大きく、経皮吸収率が不良であり、治療効果に制限が生じてしまうこと、製剤化の際、コストが高くなるという点があげられる。そこで、最近、私たちの研究室では、株式会社メドレックス社との共同研究によりILTS(Ionic Liquid Transdermal System)?という新規基剤を用いた改良版軟膏を作成し、従来の軟膏に比べて、高い経皮吸収率と治療効果が得られることを明らかにしている。
特発性後天性全身性無汗症の病態解明
特発性後天性全身性無汗症は、若者が突然汗をかかなくなり、周期的な全身の疼痛や蕁麻疹を生じる原因不明の難病です。私たちは、汗腺の周りの免疫細胞の活性化や、放出されるサイトカインがこの病気の主な原因ではないかと考え、患者さんの汗腺の解析や、疾患モデル動物の作成により、治療法開発に向けた研究を進めています。
- 患者さまへ:『特発性後天性全身性無汗症の皮膚の組織学的解析』について
文書のダウンロード
海外留学
また,海外留学に関しては、本人のプロジェクトや希望を重視しながら斡旋しています。
最近の主な留学先としては、
- St. Goege's Hospital, University of London (U.K.)
- University of Koeln (Germany)
- University of Bonn (Germany)
- University of Vienna (Austria)
- University of Illinois (U.S.A.)
- University of Munster (Germany)
- Northwestern University (U.S.A)
- The Rockefeller University (U.S.A)
- University of British Columbia (Canada)
などがあります。